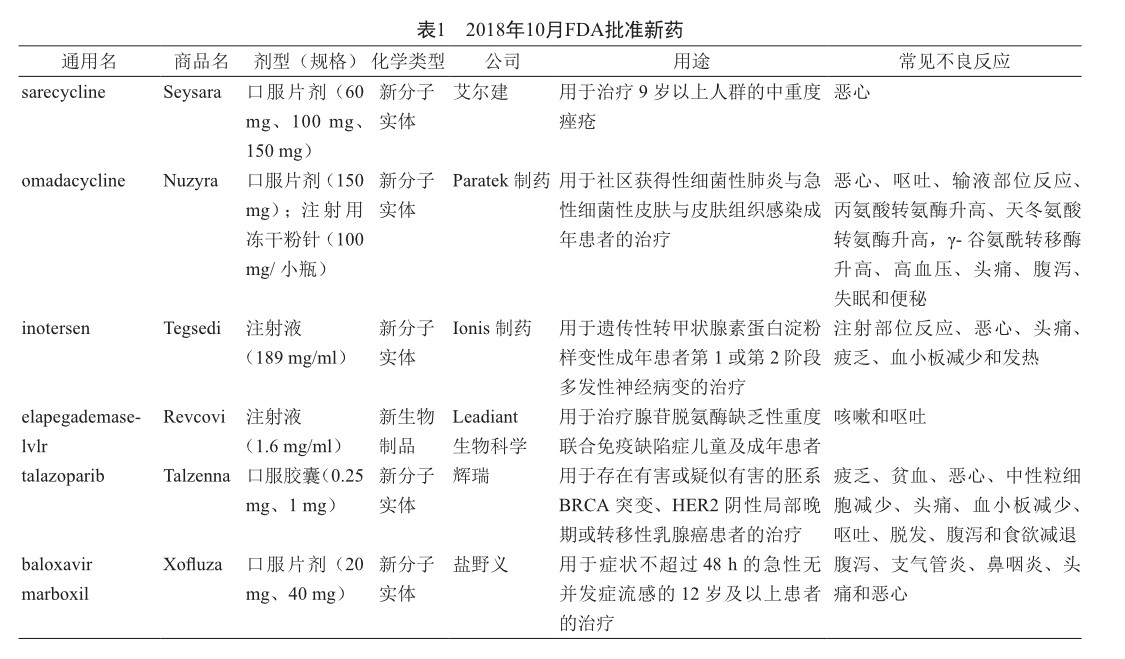
2018年10月,FDA批出5个新分子实体和1个新生物制品(表1),为治疗痤疮药品Seysara(sarecycline)、新型抗生素Nuzyra(omadacycline)、治疗多发性神经病变药物Tegsedi(inotersen)、超罕见的遗传性疾病新药Revcovi(elapegademase-lvlr)、抗癌药Talzenna(talazoparib)和治疗流感新药Xofluza(baloxavir marboxil)。
1 Seysara(sarecycline)
Seysara被批准用于治疗9岁以上人群的中重度痤疮。此病多在14~16岁发病,24~30岁逐渐缓解,但也有少数人可以在成年后持续许多年。痤疮是由于毛囊皮脂腺堵塞和发炎导致黑头、疙瘩,充满脓液的丘疹或者红肿突起。痤疮在脸部和上半身更容易出现。根据症状的严重性,对它的治疗可能包括局部疗法和全身性疗法。Seysara是一种首创(first-in-class)、窄谱四环素衍生抗生素。
2 Nuzyra(omadacycline)
Nuzyra 获“快速通道”指定和“优先审评”地位,被批准用于治疗社区获得性细菌性肺炎(community- acquired bacterial pneumonia, CABP)和急性细菌性皮肤和皮肤组织感染(acute bacterial skin and skin structure infections, ABSSSI)的成年患者。根据美国疾病预防与控制中心(CDC)估计,耐药性细菌每年在美国导致200万例感染和2.3万例死亡,其中CABP就造成了约120万例感染与7 000例死亡,最常见的主因为肺炎链球菌的感染,另外ABSSSI也是常见造成住院的主因,通常由金黄色葡萄球菌和化脓性链球菌所引起,表示抗生素耐药性的问题愈趋严重。Nuzyra是一种新型9-氨甲基环素类药物,是在四环素类抗生素米诺环素(minocycline)基础上进行化学基团修饰后得到的半合成化合物,专门设计用于克服四环素耐药性,针对广泛的细菌表现出强劲的抑菌效果,包括革兰阳性菌、革兰阴性菌、厌氧菌、非典型细菌及其他耐药菌,属创新广谱抗生素。
3 Tegsedi(inotersen)
Tegsedi 獲“孤儿药”资格和“快速通道”指定,被批准用于遗传性转甲状腺素蛋白淀粉样变性(hereditarytransthyretin amyloidosis, hATTR)成年患者第1或第2阶段多发性神经病变的治疗。hATTR是一种罕见的进展性、系统性、致死性遗传性神经疾病,是由于转甲状腺素蛋白(transthyretin, TTR)淀粉样蛋白异常形成和聚集并沉积在全身多个器官和组织,包括周围神经、心脏、肠道、眼睛、肾脏、中枢神经系统、甲状腺和骨髓。在这些组织和器官中,TTR淀粉样沉积物的逐渐积累会导致感觉、运动和自主神经功能障碍,常常对患者生活的多个方面有致衰性作用。hATTR淀粉样变性患者常表现混合表型,并经历多发性神经病变和心肌病的重叠症状。患有多发性神经病变症状的hATTR患者分为3个阶段:第1阶段患者不需要步行辅助,第2阶段患者需要步行辅助,第3阶段患者依赖轮椅。最终,hATTR淀粉样变性会在症状发作的3~15年内导致死亡。目前,hATTR淀粉样变性患者的治疗选择非常有限,还没有疾病修饰药物获批。据估计在全球范围内,大约有5万例hATTR淀粉样变性患者。Tegsedi是一种反义寡核苷酸药物,可抑制TTR蛋白(包括突变型和野生型)的生成,TTR的异常形成和聚集导致TTR淀粉样沉积,这是hATTR淀粉样变性的根本原因。
4 Revcovi(elapegademase-lvlr)
Revcovi获“孤儿药”和“快速通道”指定以及“优先审评”地位,被批准用于治疗腺苷脱氨酶缺乏性重度联合免疫缺陷症(adenosine deaminase deficiency-related severe combined immuno-deficiency, ADA-SCID)儿童及成年患者。ADA-SCID是一种极其罕见的遗传性疾病,它由 ADA 酶缺乏导致,如果不及时治疗,这种病是致命的。受 ADA-SCID 影响的患者其免疫系统受损,使患者不能抵抗细菌、病毒和真菌的感染。ADA-SCID 主要影响婴幼儿,通常在出生后的最初几个月内被诊断出来。患有 ADA-SCID 的未确诊婴儿通常在两岁前因感染而死亡。Revcovi是一种PEG化重组腺苷脱氨酶(rADA),补充人体中ADA的水平,属新的酶替代疗法。作为一种基因工程重组药物,Revcovi消除了从动物中提取酶的需求,为ADA-SCID患者提供了除骨髓移植之外的首个治疗选择。
5 Talzenna(talazoparib)
Talzenna获“优先审评”地位,被批准用于存在有害或疑似有害的胚系乳腺癌易感基因(breast cancer susceptibility gene, BRCA)突变(gBRCAm)、HER2阴性局部晚期或转移性乳腺癌患者的治疗。Myriad公司的伴随诊断试剂盒BRACAnalysis CDx test同时被批准,用于筛查适合接受Talzenna治疗的患者,即存在有害或疑似有害gBRCAm的乳腺癌患者。携带遗传性BRCA1/2基因突变的女性在70岁之前患上乳腺癌的风险高达65%。BRCA1/2是人体中与修复DNA损伤有关的基因。这些基因上发生的突变导致DNA修复无法正常进行,可能导致包括乳腺癌在内的多种癌症的发生。据悉约有5%的乳腺癌患者与BRCA1/2基因胚系突变相关,BRCA1突变导致的乳腺癌大部分为三阴性乳腺癌,而BRCA2突变更可能导致雌激素受体阳性乳腺癌。Talzenna是一种聚ADP-核糖聚合酶(PARP)抑制剂,临床前研究表明,其高度有效,具有双重作用机制,可以通过阻断PARP酶活性以及将PARP捕获在DNA损伤位点上来诱导肿瘤细胞死亡。
6 Xofluza(baloxavir marboxil)
Xofluza 获“优先审评”地位,被批准用于症状不超过48 h的急性无并发症流感的12岁及以上患者的治疗。流感是一种流感病毒所致接触性传染呼吸疾病。当患者在流感成病48 h内接受治疗,抗病毒药可能减轻症状和缩短患者疾病的时间。Xofluza是首个流感病毒5′帽状结构(CAP)依赖性内切酶活性的抑制剂。因为流感病毒基因组很小,需要依赖宿主翻译系统才能进行蛋白质的合成。因此流感病毒的信使RNA需要同时具备可供宿主细胞翻译系统识别的5′帽状(CAP)结构和3′-poly(A)尾结构。其中5′帽状结构是通过流感病毒RNA聚合酶复合体中PA亚基的内切酶活性从宿主细胞前体mRNA的5′端剪切来的“(CAP-snatching)”。因此“CAP-snatching”是流感病毒复制周期中的关键环节,而Xofluza通过抑制“CAP-snatching”内切酶而实现阻碍病毒的逆转录过程。
(上海医药战略发展研究院特约研究员 张建忠)







